V = cte/P
Ley de Gay-Lussac (1ª ley): dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura el volumen del gas disminuye.
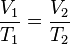

Ley de Gay-Lussac (2ª ley): Si el volumen de una cierta cantidad de gas a presión moderada se mantiene constante, el cociente entre presión y temperatura (Kelvin) permanece constante.



Yo no entendí pero...la copié así...
ResponderEliminarAJAJAJAJA igual YO JAJAJAJAJA
EliminarPodrias ponerla segun la teoria cinetica molecular?
ResponderEliminaruna pregunta que explican las leyes experimentales de los gases?
ResponderEliminar